La Banque de données des mutations du gène F7
UMD-F7
Le facteur VII de la coagulation
Le facteur VII plasmatique circulant à la concentration d’environ 0,5 ug/ml, peut se trouver sous au moins trois formes différentes : une forme monocaténaire, deux formes bicaténaires : libre ou liée au facteur tissulaire (TF). La forme monocaténaire correspond au zymogène, elle est inactive. La forme bicaténaire libre a très peu d’activité enzymatique, elle est classiquement qualifiée de forme zymogen-like. La forme liée au facteur tissulaire est la forme enzymatique active. La nomenclature protéique utilisée est celle recommandée par the human genome variation society (HGVS). Le résidu numéro 1 est la méthionine codée par le codon d’initiation au niveau du propeptide.
Structure :
Le facteur VII mature est un zymogène de sérine protéase monocaténaire avec un poids moléculaire voisin de 50 kDa. Il comprend successivement depuis l'extrémité NH2 terminale: (i) un domaine Gla comptant les 10 résidus acide gamma carboxy-glutamique (résidus 61-97), (ii) une courte région hydrophobe (résidus 97-106), (iii) deux domaines de structure analogue à celle du facteur de croissance épidermique: EGF1 (résidus 106-146) et EGF2 (résidus 147-202) (iv) le domaine catalytique formé de la triade classique: histidine (résidu 253), acide aspartique (résidu 302) et sérine (résidu 404) [O’Hara et al., 1987]. Le FVII subit au niveau de l’hépatocyte plusieurs modifications post-traductionnelles : la gamma carboxylation de 10 résidus glutamine (résidus 66, 67, 74, 76, 79, 80, 85, 86, 89 et 95) qui lui confère la propriété de se lier aux phospholipides membranaires par l’intermédiaire d’ions calcium et la glycosylation de 4 résidus : les sérines 112 et 120 au niveau de l’atome d’oxygène, et les Asparagine 205 et 382 au niveau de l’atome d’azote.
Le facteur VII activé (FVIIa) se compose de deux chaînes réunies par un unique pont disulfure entre les Cystéines 195 et 322. La chaîne légère de 17 kDa comprend le domaine Gla, la courte hélice hydrophobe et les domaines EGF1 et EGF2, la chaîne lourde de 28 kDa porte le site catalytique.
Le passage de la forme zymogène à la forme active résulte du clivage du FVII au niveau de la liaison Arg212-Ile213 par différentes protéases. L’extrémité N-terminale du domaine protéase (Ile213) s’insère ensuite au niveau du site actif pour former avec l’Asp403 le pont salin caractéristique des sérines protéases proches de la trypsine. Ce pont stabilise le site actif du FVIIa et notamment le résidu catalytique Ser404. Le facteur tissulaire accroît l’activité enzymatique du complexe FVIIa/TF vraisemblablement par l’intermédiaire de modifications conformationnelles du site actif du FVIIa. Les différentes étapes ne sont pas toutes actuellement identifiées.
Rôle :
Le FVIIa complexé au facteur tissulaire (TF) est considéré actuellement comme l'initiateur principal du processus de coagulation in vivo. Le TF, normalement absent de la circulation sanguine, est un récepteur de très haute affinité pour le FVII. Lors d'une brèche vasculaire ou lors de l'expression pathologique du TF par certaines cellules sanguines, le facteur VII forme avec le facteur tissulaire un complexe équimoléculaire en présence d'ions calcium [Banner et al., 1997]. Au sein de ce complexe, le TF joue le rôle de cofacteur, accroissant considérablement l’activité catalytique du FVIIa. Les différentes étapes conduisant à la génération du complexe enzymatique actif FVIIa/TF restent encore mal élucidées.
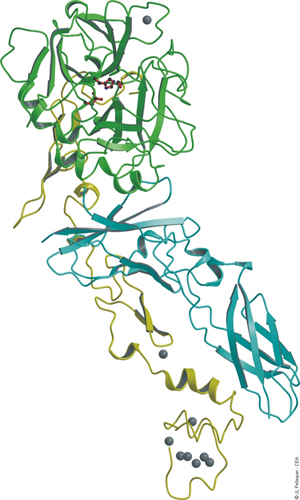
Figure : Complexe TF:FVIIa (d'après JL Pellequer - CEA Banner et al., 1997). Bleu = TF; Vert = Chaîne lourde du FVIIa; Jaune = Chaîne légère du FVIIa.